- Relevante : ¿Es relevante para la población, para la política sanitaria, para futuras investigaciones?
- Ética : ¿Es moralmente aceptable? ¿Lo aprobará un Comité de Ética de Investigación en Seres Humanos (CEISH)?
- Factible: ¿Dispone del tiempo, los recursos, los sujetos y los conocimientos técnicos adecuados?
- Interesante: ¿Obtener la respuesta anima al investigador, a las instituciones y a la comunidad?
- Novedoso: ¿Confirma, refuta o amplía hallazgos anteriores?
- Analizable: ¿Se pueden medir y alcanzar los objetivos?
Responsabilidades para realizar investigación clínica
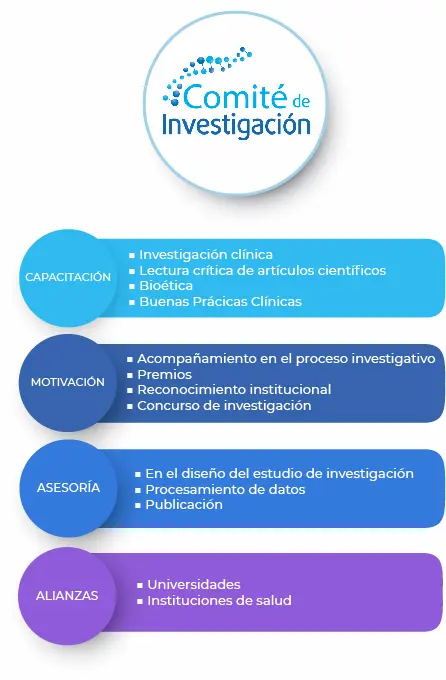
- Previamente a su iniciación, todo trabajo de investigación (protocolo) en salud debe ser presentado al Comité de Investigación, al igual que los casos clínicos, previa su publicación.
- De todo trabajo de investigación/caso clínico finalizado debe entregarse un ejemplar al Comité de Investigación.
Misión
Avanzar hacia la excelencia en la atención de la salud, a través de un proceso de investigación ético y responsable, con el fin de lograr una mejora continua, centrada en el paciente.Visión
Ser un hospital líder en investigación en salud e impulsar habilidades, destrezas y crecimiento institucional.Objetivos
 (1).png)
Requisitos y formatos para elaborar un protocolo de investigación
- Descargue formatos AQUÍ
Pasos
1. Solicitar en Enseñanza Médica personalmente o por mail:
- Formatos de cómo elaborar un protocolo de investigación o tesis
- Formatos de los requisitos para la entrega
2. Recomendación
- Si tiene una idea de investigación y necesita orientación para cumplir los criterios de REFINA, no dude en contactar al Comité
3. Elaborar protocolo de investigación
4. Requisitos para la entrega
- Solicitud de Revisión - llenada (Formato 1)
- Declaración de Helsinki - firmada (Formato 2)
- Solicitud de Exención de Obtención de Consentimiento Informado Individualizado, llenada y firmada - en caso de que aplique (Formato 3)
- Consentimiento informado - en caso de que aplique
- La versión final del protocolo perfectamente corregida
- La tesis debe estar previamente revisada por el tutor y el director de metodología, con firma en la hoja del título y el nombre respectivo con letra de imprenta
5. Entrega en Enseñanza Médica
- Protocolo o tesis enviar por e-mail (educacion@hmetro.med.ec) en formato Word
- Formatos 1, 2 y el 3 (solo en caso de que aplique), entrega física
6. Revisión y aprobación
- Revisión del protocolo en 2 - 4 semanas y reunión con los investigadores para realizar cambios o para la aprobación
¿El problema - la pregunta de investigación?
Aplicar: Criterios REFINA (FINER):
Fuente: O´Brien & Broughton, 2017
Miembros del Comité de Investigación

Coordinadora
Dra. Cornelia Dingler
Internista
corneliadingler@gmx.de
Cirugía General
Dr. Felipe Pacheco Barzallo
Cirujano general
felpache20@hotmail.com
Ginecología y Obstetricia
Dr. Iván Ortega Garrido
Ginecólogo
ivan_imog1983@hotmail.com
Medicina Interna
Dra. Sol Calero Revelo
Cardióloga
sol.calero@gmail.com
Ortopedia y Traumatología
Dr. Carlos Robles Choez
Traumatólogo
carlosc_rch@hotmail.com
Pediatría
Dra. Adriana Arnao Noboa
Infectóloga pediátrica
adri_arnao@yahoo.com
Bioestadística
Dra. Dayami Díaz Garrido
Bioestadística - Médica general
dayamidiaz1973@gmail.com
Bioestadística
Dra. Martha Fors López
Bioestadística - Médica general
forsmarthamaria@gmail.com

Enseñanza Médica
Avenida Mariana de Jesús S/N y Nicolás Arteta
170129 Quito – Ecuador
T (00 593 2) 399-8000 Ext. 2120
C / WhatsApp: (00 593) (0) 99 292-3882
E-mail: educación@hmetro.med.ec

